

pH(ピーエッチ、またはペーハー)とは、power of hydrogenの略称※で、水素イオン濃度指数(または水素イオン指数)と呼ばれ 『ある液体の中にどのくらいの水素イオンH+が含まれているか』を表す数値です。
※pHの略称(由来)については “power of hydrogen” の他 、”hydrogen power””potential of hydrogen” 等も用いられているようです。
この水素イオン濃度指数pHは、次の式によって定義されています。

[H+]は水素イオン濃度と呼ばれているもので、 溶液1リットル中に含まれている水素イオンH+の物質量(mol)を示しています。 式から分かるように、pHは水素イオン濃度[H+]の逆数の常用対数によって表されます。
例えばpH=3の液体は、その液体中に水素イオンH+が、1×10-3(mol/L)含まれていることを示しています。

水中に存在している水素イオンH+と水酸化物イオンOH-との間には、水素イオン濃度[H+]と水酸化物イオン濃度[OH-]の積(=水のイオン積)が、1×10-14(mol/L)で一定(25℃)であるため、次式の関係が成り立っています。
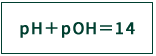
この式は、液体中の水素イオン濃度[H+]が増加したぶんだけ、その液体中の水酸化物イオン濃度[OH-]が減少することを示しています。
水中(または水溶液中)に存在する水素イオンH+と水酸化物イオンOH-の量は決まっています。
※参照:「pHとは」水のイオン積
このとき、水中の水素イオンH+と水酸化物イオンOH-のどちらが多く存在しているかによって、「酸性」「アルカリ性」と呼び方が変わります。

という関係になっている状態を表しています。
また中性とは、水素イオンH+と水酸化物イオンOH-が同じ量の状態を示しています。
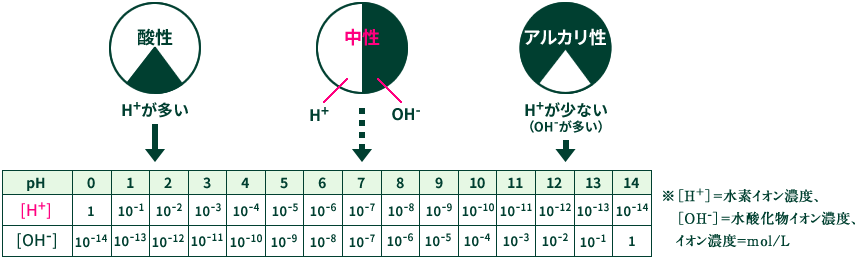
上図は、pHの数値と酸性/アルカリ性の関係を示したものです。
図から分かるように、水素イオンH+と水酸化物イオンOH-の多い/少ないによって、酸性⇔アルカリ性に呼び方が変化し、水素イオンH+(または水酸化物イオンOH-)の量に応じてpHの数値が変化しています。
水道水をはじめ、わたしたちは日常でいろいろなpH値の液体を使っています。
以下にいろいろな液体のpHを紹介します。
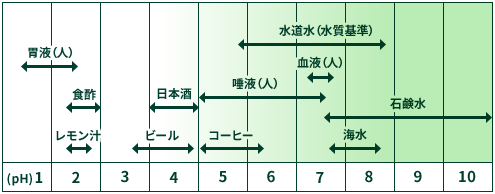
水道の蛇口から出てくる水は、いつも中性のpH7と思われるかもしれませんが、実際はそうではありません。日本国内における水道水のpHは、水質基準によってpH5.8~8.6と決められているため、水道水がこのpH範囲外となることはありませんが、そのpH範囲の中で地域や時間帯、季節などによって、水道水のpHはやや酸性のときもあれば、逆にややアルカリ性のときもあります。
水道水のような無色透明の液体のpHを、簡易的に測定するのに利用するのが「pH指示薬(または酸塩基指示薬)」と呼ばれているものです。
これは液体中の水素イオン濃度の変化に伴い、液体の色を変化させることにより、その液体の酸性度あるいはアルカリ性度を示す物質です。
以下に、代表的なpH指示薬として「BTB液」と「赤キャベツ色素の色変化」を紹介します。

BTB液はブロモチモールブルー(Bromo Thymol Blue)の略称で、有機物から成っています。 pHの数値を気にせずに、酸性/アルカリ性のどちらかだけを判定したい場合には適しています。

赤キャベツ色素は、他に紫キャベツ色素とも呼ばれており、天然のアントシアニン系色素です。
その名の通り、赤キャベツの赤紫色の部分に含まれている色素で、赤キャベツの他、 赤たまねぎ(紫たまねぎ)や茄子、ブルーベリーなどにも含まれている色素です。
赤キャベツなどを鍋で煮出すことによって、ご家庭でも簡単に赤キャベツ液を作ることができます。 またこの色素は、広く一般的に着色料として食品添加物などにも使われています。
時間をかけて何度も同じ赤キャベツ液でpH判定する、といった使い方には不向きです。
以上のように、BTB液と赤キャベツ色素にはそれぞれ特長がありますので、用途に応じて使い分けをしましょう。
私たちは生活の数多くの場面で水を使っています。
生活の中ではたいていの場合、水道水を使っていますが工業用途や飲食用途など、少し視点をかえると、そこでは様々な種類の水が使われています。 また、同じ性質であったり、同じ方法によって得られた水であっても、人やメーカー、用途などの違いによって呼び方も様々です。
ここでは、いくつかの水について、その呼び名と意味を紹介します。
蒸留水とは、水を熱して、そのときに出てくる蒸気を冷やして再び液体として抽出することによって得られる水のことをいいます。この方法によって、水中に溶解している固体や有機物を取り除いた水を生成することができます。また蒸留をくり返し行なって、不純物が少ない純度の高くなった水を純水と呼びます。
精製水とは、ろ過や蒸留によって不純物を除去した水のことをいいます。
純水とは、不純物やイオン性物質を除去した水のことをいい、蒸留およびイオン交換などを用いて、その水の電気伝導率を25℃(±1℃)で1μS/cm以下とした水のことをいいます。
蒸留水や精製水をイオン交換などによって脱イオンする、またはイオン交換水(脱イオン水)を蒸留することによって 生成することができます。 イオン交換によって得られた脱イオン水を純水と呼ぶこともありますが、この場合、有機物などが含まれています。
また、この水は電気伝導率の精密測定に用いることもあり、伝導度水と呼ばれることもあります。
脱イオン水とは、イオン交換などによって水に含まれている陽イオンと陰イオン※(塩類)を除去した水のことをいいます。 この水は、脱イオン水のほか、脱塩水、イオン交換水、といった呼び方もされています。
※陽/陰イオン=水素イオン(H+)と水酸化物イオン(OH-)をのぞく
淡水とは、海水の塩分を除去した水のことをいいます。海外では海水を水資源として、海水に含まれている余分な塩分を取り除くことによって、様々な用途へ利用する水を得る場合もあるようです。
硬水とは、カルシウムイオンやマグネシウムイオンなどを含む水のことをいい、これらイオンの含有量を示す尺度として硬度と呼ばれるものが使われています。
この硬水はミネラル水と呼ばれることもあり、地下水や山麓の水など、地底のカルシウムなどの成分が水に溶け込むことによって水の硬度が高くなります。また、海洋深層水もミネラルを多く含んだ水として知られています。軟水とは、硬水の硬度成分を除去した水のことをいいます。
水の硬度にはアメリカ硬度とドイツ硬度の2種類があり、現在はアメリカ硬度が利用されることが多いようです。
アメリカ硬度とは、水1リットル中に含まれているカルシウムイオンCa2+とマグネシウムイオンMg2+の量を 炭酸カルシウムCaCO3の量に換算したもので、単位はppmで表します。 水1リットルに対して炭酸カルシウムCaCO3の量が1mgの水を1ppmとしています。
ドイツ硬度とは、水0.1リットル中に含まれているカルシウムイオンCa2+とマグネシウムイオンMg2+の量を 酸化カルシウムCaOの量に換算したもので、単位はdHで表します。 水0.1リットルに対して酸化カルシウムCaOの量が1mgの水を1dHとしています。
硬度と硬水・軟水の関係は下図のようになっています。
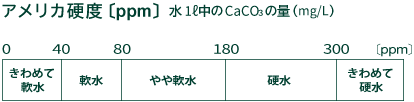
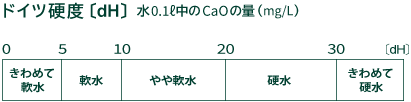
日本全国の上水道の大半は、きわめて軟水(0~40ppm、0~5dH)ですが、地域によっては少し硬度の高いところもあります。
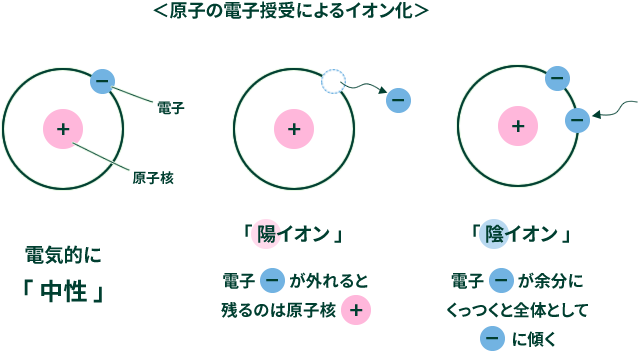
イオンとは、原子や分子が、電子を放出したり電子を受け取ったりして、正(+)や負(-)の電荷をもった状態のことをいいます。
水中では、正の電荷をもった水素イオンH+と、負の電荷をもった水酸化物イオンOH-が存在しています。
理想的な純水、つまりイオンや有機物といった水以外の不純物がまったく入っていない水は、電気を通しません。 水道水は電気を通しますが、これは水道水の中にイオンが含まれているからです。 このイオンは電解質と呼ばれ、電気を通しやすくしています。
水中に電解質であるイオンの含有量が多ければ多いほど(=イオン濃度が高いほど)、電気を通しやすくなります。 つまり『水中のイオン含有量と電気伝導度の間には相関関係がある』といえます。
水の電気伝導度を測定して、水中に含まれているイオン成分の多い/少ないを調べることによって、 水の汚れを評価したりすることもできます(イオン以外の不純物による汚れは計測不可)。
電気伝導度とは、水や水溶液、液体の電気抵抗の逆数であり、電流の流れやすさを表す数値です。単位はS/m、または μS/cm (Sはジーメンスと呼ぶ)を使います。 電気伝導度のほか、電気伝導率や導電率といった呼ばれ方もされています。
電気伝導度の数値によって、水を分類することがあります。下図に代表例として、純水や水道水と電気伝導度の関係を示します。

最近、環境にやさしいエネルギーとして『燃料電池』というものが登場しています。 水の電気分解は水に電気を流すと水素と酸素の気体が発生しますが、燃料電池はこの逆の動作で、水素と酸素を使って電気(発電)と水が発生します。
車の動力源に燃料電池を使うと、従来のような排気ガスは排出せず、発電するときに発生する水しか排出しないため、 環境にやさしいクリーンなエコカー(エコロジー・カー)として注目されています。 ここでは、その燃料電池のしくみについて紹介します。
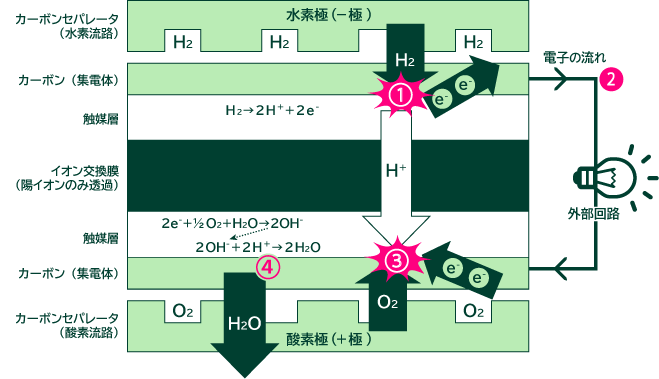
燃料電池は、酸素極(+極)と水素極(-極)からなります。 水素極と酸素極の間にはイオン交換膜があり、水素イオン(H+)のみ通すことができます。 この膜は水分がないと働かないため、燃料電池にはあらかじめ湿らせた水素や酸素を使用することがあります。
①水素極へ供給された水素(H2)は、まずカーボンセパレータ(ガス流路があります)を通り、触媒層で活性化され、水素イオン(H+)と電子(e-)に分かれます。

②電子(e-)は外部回路を通り酸素極へ流れます。
③酸素極には酸素(O2)、または空気が供給され、水素極から外部回路を通ってきた電子(e-)と酸素(O2)と水(H2O)が反応し、

④水素極からイオン交換膜を通ってきたH+と反応して

となり、水のみが排出されます。
酸素の供給には空気中の酸素を使いますが、水素はさまざまな燃料(天然ガス、メタノール、ガソリン、 プロパン、ブタンなど)から取り出します。これを『改質』といいます。
改質燃料には、水素の中に少しですがCO、CO2、NOxなども含まれます。 なかでもCOは触媒に吸着されやすく、水素が水素イオンになる反応の効率を下げてしまいます。
そこで燃料中のCO濃度を下げる試みがなされています。
イオン吸着電極とは、電極中の電子(あるいは正電荷)と 液体中の陽イオン(あるいは陰イオン)とを静電気的な力で引き合わせることにより、液体中のイオンを吸着させる電極です。 以下に、イオン吸着電極のイメージを表した図を示します。

電極間に電流を流すことによって、陽極と陰極では以下のようにそれぞれの電気化学反応が発生します。
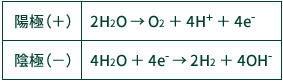
陽極では水が電子を放出して「水素イオン」と「酸素ガス」が発生し、陰極では電子を得て「水酸化物イオン」と「水素ガス」が発生します。
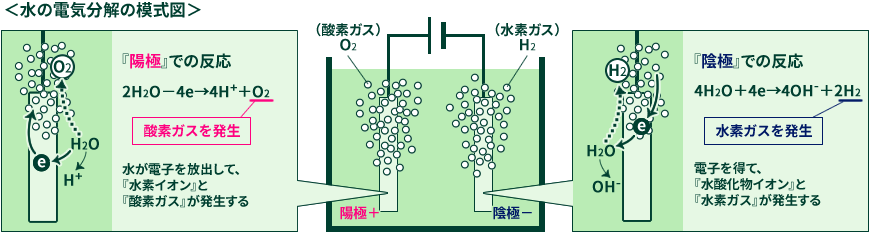
小学校や中学校で習う水の電気分解では一般的に電流を流しやすくするため、水に水酸化ナトリウムなどを溶かした水溶液を使います。 ただし、この水酸化ナトリウムは劇薬のため、使用する際には直接手に触れないようにするなど、安全面での注意が必要です。
不純物を含まない水のことを純水と呼び、絶縁体に分類されます。 しかし、わたしたちが普段使っている水道水は、微量ですが導電性を示します。これは、水道水にカルシウムなどのミネラル分や微量の塩素分(殺菌目的)が入っていて、これら成分がイオンとなって水道水に導電性を持たせているためです。
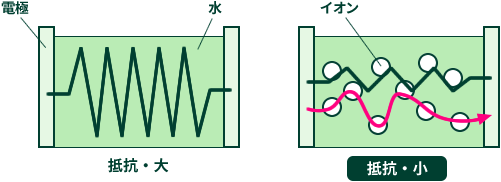
電気分解の実験では水に電気を流さなければなりませんが、水道水の導電性では足りないため、より多くの電気を流す必要があります。そこで電気を流しやすくするために水酸化ナトリウムなどの電解質(イオン)を水に入れます。
水酸化ナトリウム以外の薬品を電気分解実験に使うことはできるのでしょうか?
答えはYES。
硫酸カリウムなど比較的人体に影響の小さい電解質を使っても電気分解実験は行えます。ただし、注意しなければならないのは電解質の種類によって導電性が異なるという点です。
以下に電解質のモル導電率を示します。
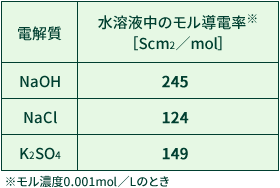
この表を見てわかるように、水酸化ナトリウムは他の電解質と比較してモル導電率が高いと言えます。 これは水酸化物イオン(OH-)は他の陰イオンと比較してとても動きやすい(導電性が高い)性質を持っているからです。
このようにモル導電率の高い電解質を使うことによって、水の導電性を高くして電気分解しやすくするという目的から電気分解実験には水酸化ナトリウムが多く使われています。また硫酸カリウム水溶液を使った電気分解実験では、硫酸カリウムの導電性が水酸化ナトリウムより低いため、電気分解する時間が長めに必要です。(同じ印加電圧の場合)
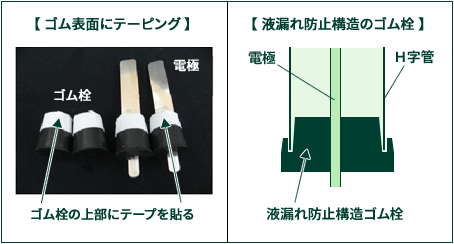
これは、ゴム栓のゴムがアルカリによって溶けるためです。
電気分解の実験では水酸化ナトリウムを使った水溶液を使うことが多いと思いますが、水酸化ナトリウム水溶液は強アルカリのため、 ゴム栓に使われているゴムが少しずつ溶けていきます。 ゴムの表面から徐々に溶けていくために、 溶け出した表面(ゴム栓とガラス管内面との間)をつたってH字管に入っている水溶液が染み出してきます。
アルカリ水溶液でなければゴムは溶けません。そのため 硫酸カリウムなどの電解質を使った水溶液を使うことによりゴム栓からの液漏れは防げます。 【注1】 硫酸カリウムは水酸化ナトリウムに比べてイオン伝導度が低いため、電気分解でガス発生に必要な時間が少し長くなります。(※同じ電気量(=電流×時間)の場合) 塩酸水溶液の使用も考えられますが、塩素ガスが発生するため安全面を考えると好ましくありません。 【注2】 すでに液漏れするゴム栓はゴム表面が溶けていますので、そのままゴム栓を使うと硫酸カリウムなどの水溶液でも 液漏れが発生する可能性があります。できれば新しいゴム栓に取り替えて実験を行なって下さい。
ゴムは表面(ゴム栓とガラス管内面との間)から徐々に溶けていきます。 下記はそれを回避するゴム栓です。
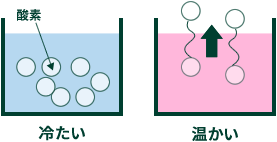
これは酸素が水に溶けやすい性質をもっているためです。
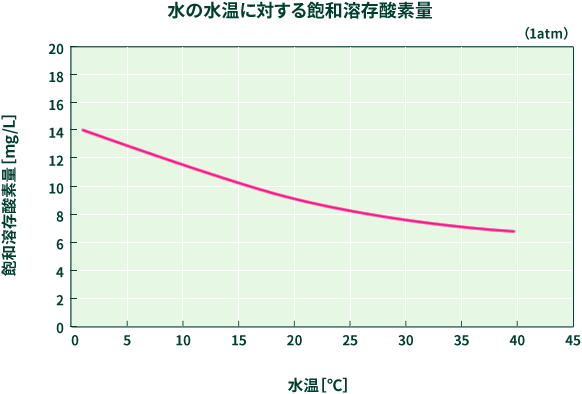
水が冷たいと酸素が溶けやすくなります。電気分解で発生した酸素はガス管に溜まらずに水に溶けてしまいます。 このようなことを回避する方法をご紹介します。
・お湯を少し加えて水温を上げる
・汲んだ水道水を室内で放置して水温を上げる
このようにして水温を上げてから実験することにより、酸素が水に溶ける影響を小さくできます。
実験の本番前にあらかじめ、同じ水で何回か動作させて(=水の電気分解を行なって) 発生した酸素をその水に溶かしておきます。
酸素が水に溶けることができる量は決まっているため(水に対する酸素の溶解度)、 あらかじめ水に酸素を溶かしておくことによって、その水に酸素が溶ける量が減少し、 実験時に酸素が水に溶ける影響を小さくできます。
これは陽極側の炭素電極が酸化するためです。 陽極側の炭素電極の酸化が起こったときに炭酸ガスが発生しますが炭酸ガスは二酸化炭素として水中に溶け込むため、 陽極側(酸素発生側)のガス管はほとんど気体がたまらない状態となることがあります。
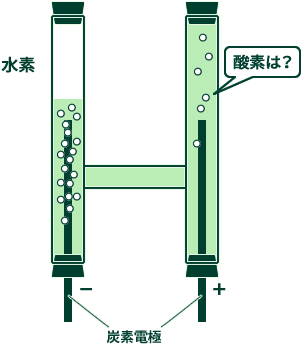
これらを回避するためには、電極の材質を選定しましょう。
陽極側での酸化はありませんが、ニッケルは酸性領域で溶解する性質があるため、電気分解実験では アルカリ水溶液(水酸化ナトリウム水溶液)を使う必要があります。
陽極側での酸化はなく、酸性領域で溶解することもなく、電気分解実験で使用する水溶液は酸でもアルカリでも 自由に選択することができます。ただし、白金は高価なため電極の価格が高いことが難点です。